QMS( Quality Management System ) に係る業務支援
1.QMS構築の基本的な実施方針
◼ QMS構築のためのPDCAサイクルの考え方
一般的なマネジメントシステムの考え方として、企業などの組織がマネジメントシステムを構築する際に、まず考えることは、組織が取り組むべき課題(目標・目的)の設定です。そして、課題の設定のためには、組織の内外にあるリスクを洗い出す作業として「リスクマネジメント」または「リスクアセスメント」を実施する必要があります。
例えば、環境マネジメントシステム(ISO 14001)を構築する場合、組織を取り巻く全ての環境管理事項(資源、廃棄物、生態系への影響など)を管理することは不可能です。経営の観点からみても、限られた資源(人・モノ・金)を、環境管理のためだけに重点的に投入する余裕はないでしょう。そこで優先順位を決めます。環境上の問題点を列挙し、影響の大小を評価し、影響の大きいものから優先的に管理します。
これは、どんな種類のマネジメントシステムを構築する場合でも同じです。まず管理する対象(品質、環境、情報セキュリティなど)における問題点を列挙し、リスクの大きさに応じて優先順位を決め、課題を設定します。
次に、課題を解決するための「計画・方策」を立て、それを「実施」します。さらに、実施した結果が課題の解決につながったかどうかを検証し、必要に応じて課題を見直したり、実施方法を変更するなどの改善をして、次の活動につなげていきます。
このように、課題の設定に始まる「計画(Plan)→実施(Do)→見直し(Check)→改善(Action)」という組織活動のループを、「PDCA サイクル」と呼びます。ISO のマネジメントシステムでは、個別の管理対象に焦点を当ててPDCA サイクルを回すこと、すなわち「継続的改善」を行っていくことが要求事項として定められています。

◼ lSO13485(医療機器の品質マネジメントシステム-規制目的のための要求事項)に基づくQMSの構築について
lSO13485規格で求められる管理すべき対象(管理対象)は、「医療機器の品質」です。そして、各々の組織はISO13485
規格に基づいて「品質マネジメントシステム(QMS:Quality ManagementSystem)を構築し、PDCA サイクルを回して、
継続的改善を図っていくことになります。
ISO9001は、製造業からサービス業まであらゆる業種に対応可能です。汎用性がある分、医療機器に適用しようとすると、その安全性を確保しきれないという問題がありました。
そこで開発されたのが、ISO13485です。ISO9001をベースに、医療機器の安全性や品質を確保するのに必要な要求事項が追加されています。
ISO13485には、医療機器特有の要求事項として、
・要員の健康、清潔さ及び衣服
・医療機器のバッチに対するトレーサビリティの確保
・製品の洗浄性及び汚染管理
・滅菌医療機器(注射器、メス、ピンセットなど)に対する固有の要求事項
・(能動)埋込み医療機器(ペースメーカー、人工内耳など)固有の要求事項
等々が規定されています。
ISOに参加する各国は、国民の健康維持・向上のため、医療機器を厳しく規制しています。ISO13485が「規制目的のための要求事項」とされているのは、このためです。
また、ISO13485は、ISO9001のキーワードである「顧客満足」「(品質マネジメントシステムの)継続的改善」という表現が削除されています医療機器の顧客満足とは安全性を担保することであり、仕組みは改善する以前に効果的に(要は安全に)機能しなければいけなないという考え方があるからです。
ISO13485の目的は、世界中の医療機器法令の整合化を促進することであり、顧客やら仕組みの改善といった事柄とは直接関係がないのです。
ISO13485の中には、「国又は地域の法令(が要求する)」といった文言が頻繁に出現します。法令に従えということです。
ISO9001を始めとする他のISO規格が、自社の特徴を生かしたマネジメントシステムを尊重するのに対して、ISO13485では、何よりもまず法令を順守するシステムが優先されます。
2.QMS構築の工程について
◼ IQMSの構築の工程表とPDCAサイクル
組織が置かれている状況は、業種や会社の規模、地域や従業員などのさまざまな要因によって決まるため、列挙する
課題も優先順位を決める判断基準も、課題を解決する方法も組織ごとに異なります。つまり、構築するマネジメントシ
ステムは、一律ではなく組織によって異なるものができると考えます。
ただし、骨子となる工程についてはマイルストーンを設けて、「計画(Plan)→実施(Do)→見直し(Check)→改
善(Action)」というPDCAのサイクルの考え方には共通のものがあり、一般的なマネジメントシステムの構築の進め方を採用します。

3.QMS構築の進め方ついて
◼ PDCAの実行の要求
- QMSの特徴的として、すべての活動においてP(Plan),D(DC),C(Check),A(Action)のサイクルを回すことが要求されます。
- 全体では「QMSをどのように維持していくか」を検討し,計画,実施.監視・測定,見直しをして次の計画を立てる活動があります。
- このサイクルは,年間を通して実施する場合や月度で実施する場合などさまざまです。
- たとえば.事業所全体として年初の方針計画・教育計画、購買先の評価計画・監査計画、QMSの改善計画など,年間を通じて計画を実行し、結果を確認してマネジメントレビューを実施するというようなサイクルが考えられます。
- また,品目ごとの製品実現計画のように,設計開発の計画をPDCAで回すものや,生産計画あるいは製品標準書にしたがって製造工程のPDCAを回すもの,さらに細部では設計開発の一部である設計の妥当性確認について計画にしたがって評価を実行したか結果を確認するもの,製造工程について工程の妥当性を確認するものなどが考えられます。
- 構造設備の保守も場当たり的にやるのではなく,あらかじめ計画された頻度で実施し,必要なメンテナンスを行うことが重要です。すなわち,QMSでは,まず何かを実行する前に必ず計画が作成されなければならず,さらに計画どおりに実施できたか,見直しは必要かなどを,PDCAサイクルを回す必要があります。

図)全体のPDCAと品目ごとのPDCA

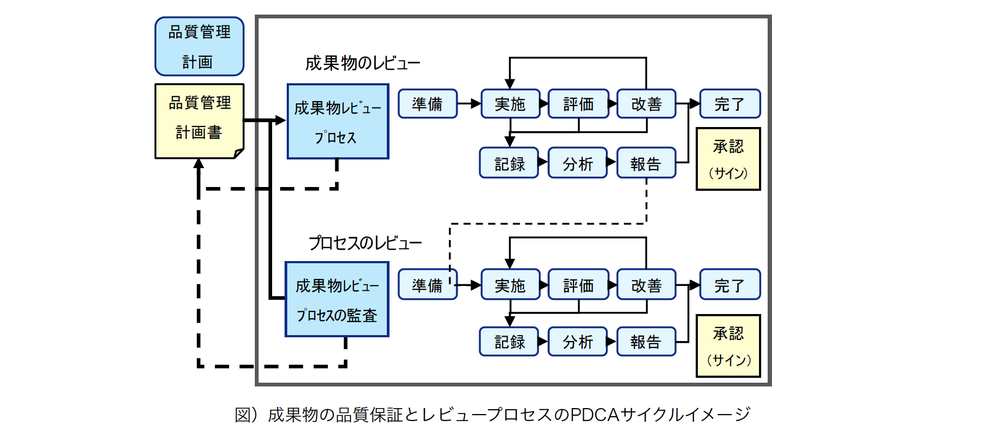
◼ 成果物の品質保証とレビュープロセス
弊社では、プロジェクトの品質管理を保つため、報告書等の成果物のみならず、成果物を生み出す母体としてのプロジェクト管理やプロジェクトの各プロセス、及び成果物やプロセスに対する各種レビューといった品質保証プロセスを品質管理の対象に加え、日々実践しています。
成果物に対する品質保証は、成果物のレビュー、及び成果物レビュープロセスの監査の2つの側面から実施しています。
いずれも、「準備」「実施」「評価」「改善」「完了」のPDCAサイクルで実行し、実行内容を「記録」「分析」「報告」することにより客観的に可視化された運営を図っています。
◼ 品質管理計画のフロー図

※ QMS省令の要求する文書の内容そして何より内部監査の結果を踏まえ、予め設定した、マイルストーンごとにレビューすべき品質管理基準
例1 【◯月下旬】
-「フォローアップデータについて漏れがなく、内容も公表資料と齟齬がないか?また、検索方法は機能的か?」
例2 【◯月上旬】
-「分析の切り口は十分か?不足する切り口はないか?」
例3 【◯月中旬】
-「調査結果の取りまとめにおいて、読み手の立場から、参考にし易い構成・表現等となっているか?」
4.QMS省令への対応ついて
◼ 製造販売業者に体制省令が求める体制のイメージ
※輸入品の場合(製造販売業者がライセンスホルダー)
QMSを文書化し、実行sh、文書・記録類を管理する体制を整備する。
① QMS省令の要求する文書(品質マニュアル、手順書、関連文書)を整備する(QMS省令第6条、第7条関連)
② ①にはQMSの各プロセスの関係や関連する組織を明確にし、PDCAを含む管理方法を含める(QMS省令第5条関連)
③ ①の文書を維持管理するための手順を作成し、実施する(QMS省令第8条、第67条関連)
④ QMS省令の要求する記録を維持管理するための手順を作成し、実施する(QMS省令第9条、第68条関連)
〔人員〕
管理監督者、管理責任者、統括製造販売責任者、国内品質業務運営責任者の責任と権限を明確にするとともに、その責務を適正に遂行出来る適切な配置をする。

◼ QMS省令の構成
QMS省令は,製造販売業者が医療機器を製造販売するにあたり、遵守しなければならない規制である。また,製造販売業者は製造業者に対してQMSによる管理を実施させなければならない。
QMS省令は、大まかにいえば、第2章として国際規格であるlSO13485の要求事項を取り込み,第3章として日本独自の要求事項を付け加えたものである。

◼ 品質管理システムに係る要求事項(品質マネジメントシステム)
第2節「品質管理監督システム」は第5条~第9条からなり、品質管理監督システム(品質マネジメントシステム)の基本となる要求事項を自社の決め事として落としこみ、文書化することを規定しています。
• どのような製品を製造するのか
• 製造所(場所)の確保・必要な組織,資源,設備,人員など
• どのような工程をつくるか
• その工程はどのような順番で‘どのように関連させて進めるか・各組織,工程をどのように管理するか
など、いろいろと考えることがあり,これらを整理して製造所を立ち上げていくことになります。
また、会社としての決め事を就業規則等で文書化して,実行するしくみも立ち上げることになります。さらに製造管理、品質管理に係る決め事も同様に立ち上げていく必要があります。
その時に、この第2節「品質管理監督システム」の規定が参考になります。何を決め、何を文書化すれば/記録すればうまくいくかが、ここに記されています。

◼ QMS省令の主な要求項目
- QMS省令は全80条からなり、すべてを網羅的に理解するのは困難です。
- 弊社では多くの条文からなるQMS省令の要求事項を大きく①マネジメントプロセス、②製品実現のプロセス、③サポートプロセス、④文書・記録の管理の4つに分類して、全体像を理解することを推奨しています。
- 全体像を理解することで、細部の要求事項がわかり易くなることが期待出来ます。

◼ QMS省令の4大要求事項

合同会社レジェルマン
〒160-0023
東京都新宿区西新宿1-20-3
西新宿高木ビル 8F
TEL:03-6890-3460
FAX:03-6890-3341
info@legerement.net
